摘要
根據《國家食品藥品監(jiān)督管理總局立法程序規(guī)定》(總局令第1號)�,CFDA制定了2018年立法計劃���,經局務會議審議通過����,予以公布��。
內容
為貫徹落實黨的十九大精神���,食品藥品監(jiān)管總局堅持圍繞中心����、服務大局����、突出重點、協(xié)調推進��,以2020年基本建成科學完備的食品藥品安全法律制度體系為目標,根據《國家食品藥品監(jiān)督管理總局立法程序規(guī)定》(總局令第1號)�����,制定了2018年立法計劃����,經局務會議審議通過���,予以公布�。
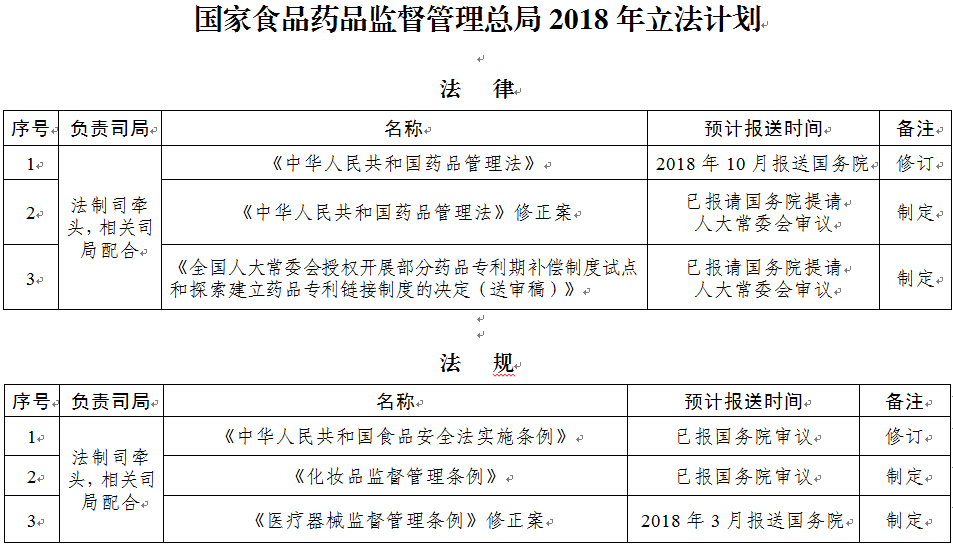
2018年立法項目共36部�����,其中�����,法律3部:一是繼續(xù)推動《中華人民共和國藥品管理法》修正案出臺���;二是繼續(xù)推動《全國人大常委會授權開展部分藥品專利期補償制度試點和探索建立藥品專利鏈接制度的決定》出臺�����;三是形成《中華人民共和國藥品管理法》修改草案送審稿����,按程序報請國務院審議。
法規(guī)3部:一是推動完成《中華人民共和國食品安全法實施條例》修訂�����;二是加快《醫(yī)療器械監(jiān)督管理條例》修改進程�����,力爭第一季度向國務院報送修正案草案;三是繼續(xù)推動《化妝品監(jiān)督管理條例》盡快出臺���。
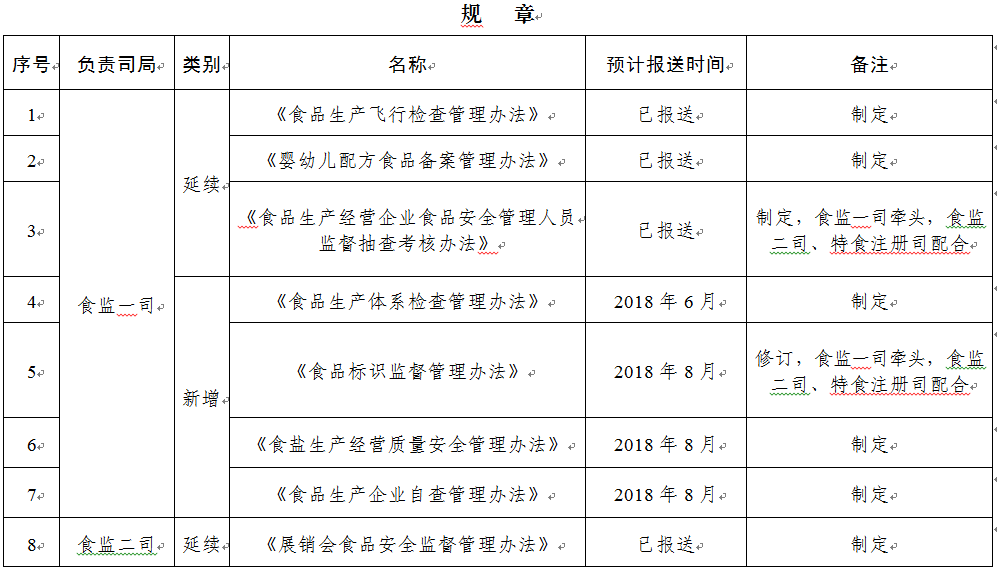
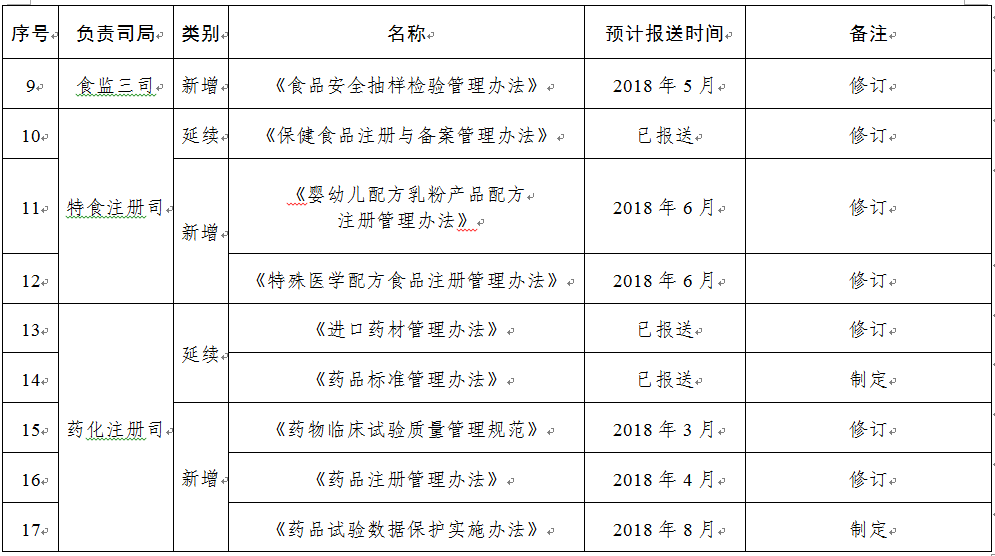
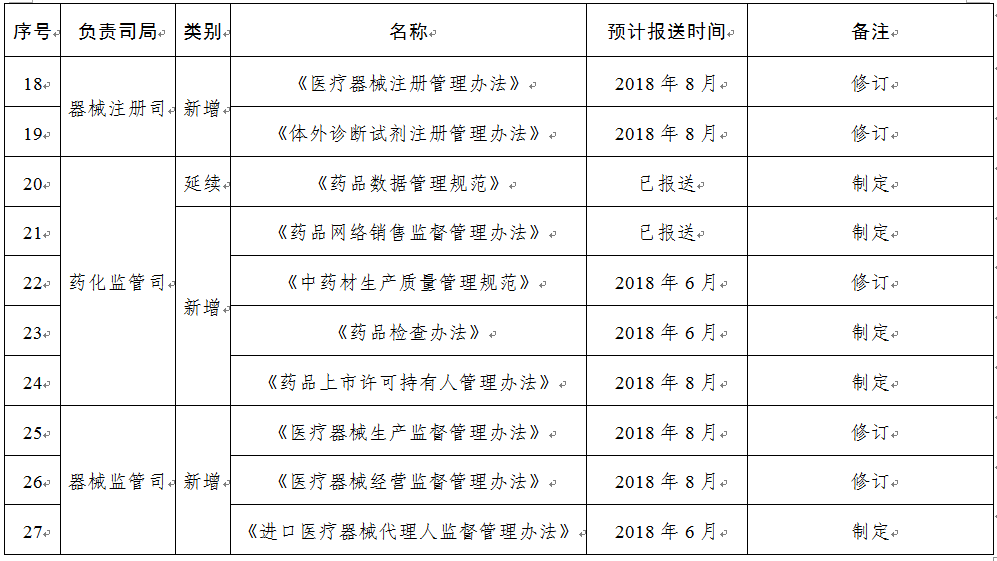
規(guī)章31部:一是圍繞食品安全法���,制修訂食品類配套規(guī)章12部;二是按照深化藥品醫(yī)療器械審評審批制度改革要求�,制修訂藥品醫(yī)療器械類規(guī)章15部;三是為加快食品藥品法治建設����,制修訂綜合類規(guī)章4部。
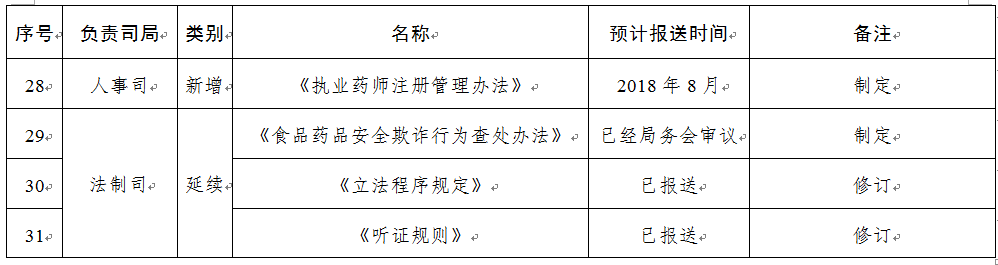
相關資料